Triedy anorganických zlúčenín
Logické pokračovanie pravidelného zákonaje klasifikácia anorganických zlúčenín. Podobne ako klasifikácia samotných prvkov sa klasifikácia chemických zlúčenín vizuálne odráža v periodickom systéme, a preto je objektívne prirodzene a vedecky založená.
Najdôležitejšie triedy anorganických zlúčenín: soli, oxidy, kyseliny, zásady (hydroxidy).
Klasifikácia látok značne uľahčujeprocesu ich štúdia. Je veľmi jednoduché charakterizovať vlastnosti jednotlivých predstaviteľov určitých tried, ak sú známe typické chemické vlastnosti analyzovanej triedy.
Triedy anorganických zlúčenín: oxidy
Oxidy sú zlúčeniny prvkov s kyslíkom, v ktorých je tento prvok pripojený k atómu prvku. Prakticky všetky prvky okrem troch inertných plynov - argónu, hélia, neónov - tvoria oxidy.
Triedy anorganických zlúčenín: hydráty oxidov
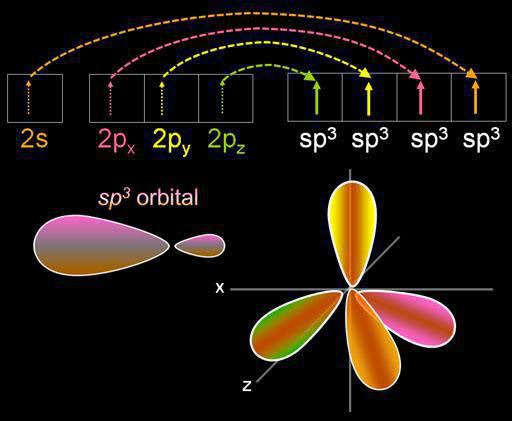
Drvivá väčšina oxidov priamo alebopriamo tvoria zlúčeniny s vodou, ktoré sa nazývajú oxidy hydráty alebo hydroxidy. Zloženie hydrocididu je vyjadrené všeobecným vzorcom E (OH) x, kde E je prvok, ktorý tvorí hydroxid, x znamená stupeň oxidácie v zodpovedajúcom oxide.
V závislosti od chemickej povahy prvkuhydroxidy sú rozdelené na hydráty zásaditých oxidov (báz), hydráty amfotérnych oxidov (amfoterné hydroxidy), hydráty kyslých oxidov (kyselín). Pripojenie hydroxidu na určitú triedu zlúčenín je určené umiestnením prvku v periodickom systéme, ktorý určuje relatívnu stabilitu väzieb medzi prvkom a kyslíkom - na jednej strane a medzi kyslíkom a vodíkom - na druhej strane.
Triedy anorganických zlúčenín: kyseliny
Medzi kyseliny patria chemické zlúčeniny,pozostávajúci z niekoľkých atómov vodíka, ktorý je schopný posunúť sa na kov za vzniku solí. Skupina atómov, ktorá zostala po odštiepení molekuly kyseliny atómov vodíka, sa nazýva zvyšok kyseliny.
Triedy anorganických zlúčenín: soli
Soli sa považujú za produkty čiastočného aleboúplná substitúcia atómov vodíka za atómy kovov alebo OH skupín báz pre zvyšky kyselín. V niektorých prípadoch môže byť vodík v kyselinách nahradený nielen kovom, ale inou skupinou atómov, ktoré majú kladný náboj (katión). V závislosti od zloženia a vlastností soli sú rozdelené na typy: kyslé, základné, stredné, komplexné.
Priemerné (normálne) soli vznikajú v dôsledkuúplná substitúcia atómov vodíka kyselín pre kovové (katiónové) alebo hydroxylové skupiny v zásadách pre kyslé zvyšky. Stupeň oxidácie kovu a náboja kyslého zvyšku musí byť známy, aby mohol byť správne formulovaný vzorec priemernej soli. Sú navzájom kombinované v takých rozmeroch, že soľ je elektricky neutrálna.
Kyslé soli sa získajú s čiastočnou náhradouAtómy vodíka v kyselín kovu. Kyslé soli sú tvorené iba viacsýtne kyselinu. Proces z kyslých solí vzorca sú také, že ešte soli médium: stanovený kladný náboj a zvyšok kyseliny, a častice sú spojené dohromady v pomere, ktorý neporušuje princíp molekúl elektroneutrality.
Základné soli sa získajú v dôsledku neúplnostisubstitúcia OH skupín báz alebo amfoterných hydroxidov za kyslé zvyšky. Vzorce základných solí pozostávajú z rezíduí viaczyselných báz alebo amfoterných hydroxidov, ktoré čiastočne stratili hydroxylové skupiny a zvyšky kyselín. Rovnako ako vo všetkých predchádzajúcich verziách je potrebné dodržiavať princíp elektroneutrality.
</ p>