Hovorme o tom, ako určiť typ hybridizácie
Hovorme o tom, ako určiť typ hybridizácie a tiež zvážiť geometrickú štruktúru molekuly.
História vzhľadu
Na začiatku dvadsiateho storočia L. Pauling navrhol teóriu geometrie molekúl s kovalentnou väzbou. Ako základ pre formovanie komunikácie sa uskutočnilo prekrývanie elektrónových oblakov. Metóda sa nazýva valenčné väzby. Ako určiť typ hybridizácie atómov v zlúčeninách? Autor teórie navrhol vziať do úvahy miešanie hybridných orbitálov.
definícia
Aby sme pochopili, ako určiť typ hybridizácie v zlúčeninách, skúmme, čo tento termín znamená.

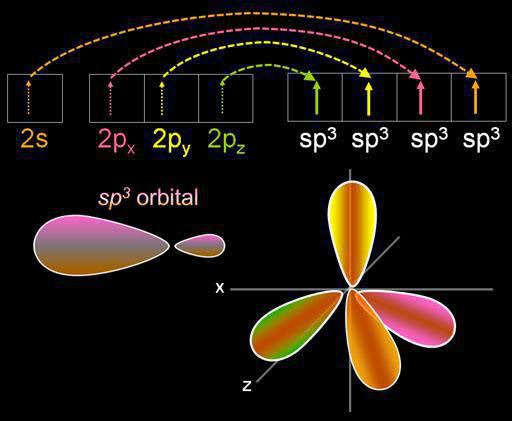
Hybridizácia je miešanieelektronické orbitály. Tento proces je sprevádzaný distribúciou energie v nich, zmenou ich formy. V závislosti od toho, koľko s- a p-orbitálov je zmiešaných, môže byť typ hybridizácie iný. V organických zlúčeninách môže atóm uhlíka existovať v stave sp, sp2, sp3. Existujú zložitejšie formy, v ktorých sa okrem sp, d-orbitals zúčastňujú.
Pravidlá detekcie anorganických látok v molekulách
Identifikujte možnosť hybridizácie zlúčeníns kovalentnou chemickou väzbou, majúci typ ABn. A je základný atóm, B je ligand a n je číslo od dvoch alebo viac. V takejto situácii sa k hybridizácii pripoja len orbitálne valencie hlavného atómu.
Metódy určovania
Hovoríme podrobnejšie o tom, ako určiť typhybridizácia. V chemickom zmysle tento pojem znamená zmenu energie a tvaru orbitálov. Podobný proces sa pozoruje v tých prípadoch, kde sa elektróny používajú na vytvorenie väzby, ktoré patria do rôznych typov.

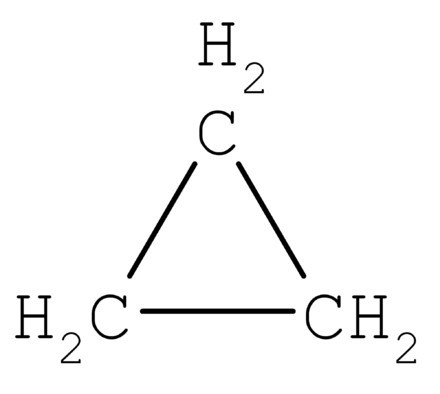
Aby sme pochopili, ako určiť typ hybridizácie,zvážte molekulu metánu. Táto látka je prvým predstaviteľom homológnej série nasýtených (limitujúcich) uhľovodíkov. Vo vesmíre molekula CH4 je tetraedrón. Jediný atóm uhlíka vytvára väzby s vodíkom, podobný energii a dĺžke. Na vytvorenie takýchto hybridných oblakov sa používajú tri p- a jeden es-elektrón.
Štyri mraky sú zmiešané a sú štyriidentických (hybridných) druhov, ktoré majú tvar nepravidelného čísla osem. Tento typ hybridizácie sa nazýva sp3. Všetky uhľovodíky, ktoré obsahujú len jednoduché (jednoduché) väzby, sa vyznačujú týmto typom hybridizácie uhlíkového atómu. Valentínsky uhol je 109 stupňov 28 minút.
Poďme pokračovať v rozhovore o tom, ako určiť typhybridizácia. Príklady nenasýtených uhľovodíkov z radu etylénu poskytujú myšlienku sp2-hybridizácie. Napríklad v molekule etylénu štyroch valenčných elektrónov pri tvorbe chemickej väzby sa používajú iba tri. Zvyšný nehybridný p-elektrón ide na vytvorenie dvojitej väzby.
Acetylén je najjednoduchším zástupcomtriedy CnH2n-2. Charakteristickou vlastnosťou tejto triedy uhľovodíkov je prítomnosť trojitej väzby. Zo štyroch valenčných elektrónov atómu uhlíka iba dva menia svoju formu a energiu a stávajú sa hybridnými. Dva zvyšné elektróny sa podieľajú na tvorbe dvoch dvojitých väzieb, ktoré určujú nenasýtený charakter tejto triedy organických zlúčenín.
záver
Vzhľadom na otázku kovalentnéhochemické väzby pre organické a anorganické látky, berú do úvahy hybridizáciu atómových orbitálov. To prispôsobuje ich energiu a tvar. Elektrón umiestnený v blízkosti jadra viazaného atómu je charakterizovaný súborom orbitálov, ktoré majú rovnaké kvantové číslo. Informácie o type hybridizácie umožňujú vyhodnotiť chemické vlastnosti látky.
</ p>