Fyzikálne a chemické vlastnosti síry
Síra - pomerne bežná v prírodechemický prvok (šestnásta v obsahu zemskej kôry a šiesty v prírodných vodách). Existujú natívna síra (voľný stav prvku) a jeho zlúčeniny.

Síra v prírode
Medzi najdôležitejšie prírodné minerály síry,názov železo pyrites, sfalerit, galena, cinnabar, antimonit. V oceánoch je obsiahnutá hlavne vo forme síranov vápnika, horčíka a sodíka, ktoré určujú tuhosť prírodných vôd.
Ako získavajú síru?
Extrakcia sírnych rúd sa uskutočňuje rôznymi metódami. Hlavným spôsobom, ako produkovať síru, je roztaviť ju priamo do zeme.
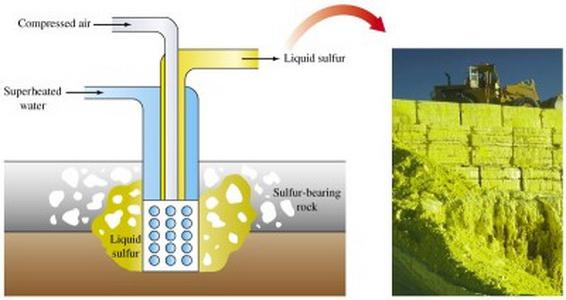
Otvorený spôsob extrakcie zabezpečujePoužitie rýpadiel, odstraňovanie horninových vrstiev, ktoré pokrývajú síru. Po rozdrvení vrstiev rudy sa do taviaceho zariadenia dostávajú výbuchy.
V priemysle získava síra ako vedľajší produktvýrobné procesy v peciach na tavenie počas rafinácie ropy. Vo veľkých množstvách je prítomný v zemnom plyne (vo forme anhydridu síry alebo sírovodíka), pri ktorom sa extrahuje na steny použitého zariadenia. Jemne rozptýlená síra, ktorá bola ulovená z plynu, sa používa v chemickom priemysle ako surovina na výrobu rôznych výrobkov.
Táto látka môže byť získaná z prírodnýchplynný oxid siričitý. Na tento účel sa používa metóda Claus. Spočíva v aplikácii "sírových jám", v ktorých sa odplyňuje síra. Výsledkom je modifikovaná síra, ktorá sa bežne používa pri výrobe asfaltu.
Základné alotropické modifikácie síry
Síra je vlastná alotropii. Veľké množstvo alotropických modifikácií je známe. Najznámejšie sú kosoštvorcové (kryštalické), monoklinické (ihličkové) a plastové síry. Prvé dve modifikácie sú stabilné, tretie pri tuhnutí sa mení na kosoštvorcový.

Fyzikálne vlastnosti charakterizujúce síru
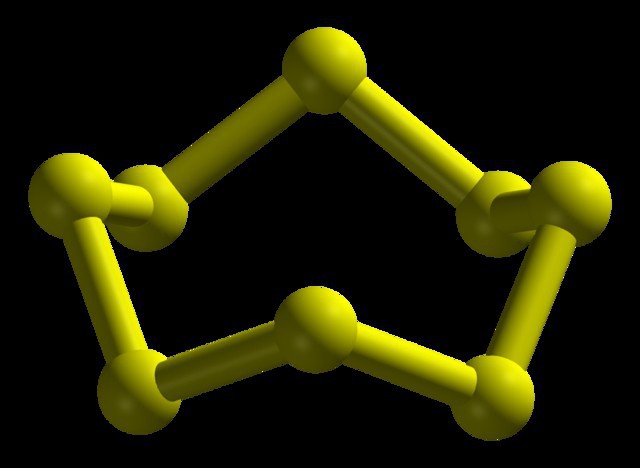
Molekuly ortorombických (a-S) a monoklinických (β-S) modifikácií obsahujú 8 atómov síry, ktoré sú spojené v uzavretom cykle jednoduchými kovalentnými väzbami.

Za normálnych podmienok má síra kosoštvorcovú modifikáciu. Je to žltá pevná kryštalická látka s hustotou 2,07 g / cm3, Roztaví sa pri 113 ° C. Hustota monoklinickej síry je 1,96 g / cm3, jeho teplota topenia je 119,3 ° C
Pri tavení sa síra zvyšuje objemom asa stáva žltou kvapalinou, ktorá sa roztrhne pri teplote 160 ° C a zmení sa na viskóznu tmavohnedú hmotu, keď dosahuje približne 190 ° C. Pri teplotách presahujúcich túto hodnotu klesá viskozita síry. Pri teplote približne 300 ° C sa znova mení na kvapalný tekutý stav. To je vysvetlené skutočnosťou, že pri zahriatí síra polymerizuje, čím sa zvyšuje dĺžka reťazca so zvyšujúcou sa teplotou. A keď teplota prekročí 190 ° C, polymérové jednotky sa zničia.

Keď sa tavenina síry ochladzuje prirodzenevalcovité tégliky sa vytvárajú tzv. šedo-diamantové zúbkované kryštály, ktoré majú deformovaný tvar vo forme oktaedry s čiastočne rezanými hranami alebo uhlami.
Ak je roztavená látka podrobená ostrému(napríklad pomocou studenej vody), je možné získať plastovú síru, ktorá je elastická gumovitá hmota hnedej alebo tmavo červenej farby s hustotou 2046 g / cm3, Táto úprava, na rozdiel od kosoštvorcovej amonoklinický, je nestabilný. Postupne (v priebehu niekoľkých hodín) mení farbu na žltú, stáva sa krehkou a mení sa na kosoštvorcový.
Pri mrazení sírnych pár (silne zahriate) s kvapalným dusíkom sa vytvára fialová modifikácia, ktorá je stabilná pri teplotách nižších ako mínus 80 ° C.
Vo vodnom prostredí je síra prakticky nerozpustná. Má však dobrú rozpustnosť v organických rozpúšťadlách. Chudobné správanie elektriny a tepla.
Teplota varu síry je 444,6 ° C. Proces varu je sprevádzaný uvoľňovaním oranžovo-žltých výparov pozostávajúcich prevažne zo S8, ktoré sa disociujú po následnom zahrievaní, čo vedie k vzniku rovnovážnych foriem S6, S.4 a S2, Ďalej sa pri zahrievaní rozkladajú veľké molekuly a pri teplotách nad 900 stupňov páry pozostávajú v podstate iba z molekúl S2, disociácia na atómy pri 1500 ° C.
Aké sú chemické vlastnosti síry?
Síra je typická nekovová. Je chemicky aktívny. oxidácia-Redukčné vlastnosti síry sa prejavujú vvzhľadom na súbor prvkov. Pri zahrievaní sa ľahko spája s prakticky všetkými prvkami, čo vysvetľuje jeho povinnú prítomnosť v kovových rudách. Výnimkou sú Pt, Au, I2, N2 a inertné plyny. Stupeň oxidácie, ktorý vykazuje síru v zlúčeninách, -2, +4, +6.
Vlastnosti síry a kyslíka spôsobujú jeho spaľovanie vo vzduchu. Výsledkom tejto interakcie je tvorba síry (SO2) a kyseliny sírovej (SO3) anhydridov používaných na výrobu kyseliny sírovej a sírovej.
Pri izbovej teplote sa redukčné vlastnosti síry prejavujú len vo vzťahu k fluóru, pri ktorom sa vytvára fluorid sírový:
- S + 3F2 = SF6.
Pri zahrievaní (vo forme taveniny) reaguje s chlórom, fosforom, kremíkom, uhlíkom. V dôsledku reakcií s vodíkom vytvára okrem sirovodíka sulfáty kombinované so všeobecným vzorcom H2SH.
Oxidujúce vlastnosti síry sú pozorované, keďinterakcie s kovmi. V niektorých prípadoch možno pozorovať pomerne násilné reakcie. V dôsledku interakcie s kovmi sa vytvárajú sulfidy (zlúčeniny síry) a polysulfidy (viacsirné kovy).
Pri dlhšom zahrievaní reaguje s koncentrovanými činidlami pôsobiacimi pri pôsobení kyseliny, zatiaľ čo oxiduje.
Ďalej uvažujeme o hlavných vlastnostiach zlúčenín síry.
Oxid siričitý
Oxid síry (IV), tiež nazývaný oxid siričitýa anhydrid síry je plyn (bezfarebný) s ostrým zadusivým zápachom. Má vlastnosť skvapalňovania pod tlakom pri izbovej teplote. SO2 je kyslý oxid. Charakterizovaná dobrou rozpustnosťou vo vode. Tým sa vytvorí slabý, nestabilné kyseliny siričitej, ktorý existuje len vo vodnom roztoku. Reakcia oxidu siričitého s alkalickými siričitany vytvorený.
Rozlišuje pomerne vysokú chemickú hodnotuaktivitu. Najvýraznejšie sú redukčné chemické vlastnosti oxidu sírového (IV). Takéto reakcie sú sprevádzané zvýšením stupňa oxidácie síry.
Oxidačné chemické vlastnosti oxidu sírového sa prejavujú v prítomnosti silných redukčných činidiel (napríklad oxidu uhoľnatého).
Oxid sírový
Oxid sírový (anhydrid síry) je najvyšší oxidsíra (VI). Za normálnych podmienok je to bezfarebná prchavá kvapalina s dusivým zápachom. Má vlastnosti mrazu pri teplotách pod 16,9 stupňov. Zmes rôznych kryštalických modifikácií tuhého oxidu sírového sa vytvorí. Vysoké hygroskopické vlastnosti oxidu síry spôsobujú jeho "dym" vo vlhkom vzduchu. V dôsledku toho sa vytvárajú kvapôčky kyseliny sírovej.
Sírovodík
Sírovodík je binárna chemická zlúčenina vodíka a síry. H2S je toxický, bezfarebný plyn, charakteristickýktorého charakteristiky sú sladká chuť a vôňa zhnitých vajec. Taví sa pri mínus 86 ° C, varí sa pri -60 ° C. Je tepelne nestabilná. Pri teplotách vyšších ako 400 ° C sa sírovodík rozkladá na S a H2. Je charakterizovaná dobrou rozpustnosťou v etanole. Rozpúšťa sa zle vo vode. V dôsledku rozpustenia vo vode vzniká slabý sírovodík. Sírovodík je silné redukčné činidlo.

Horľavý. Keď sa spaľuje vo vzduchu, môžete vidieť modrý plameň. Vo vysokých koncentráciách je schopný reagovať s mnohými kovmi.
Kyselina sírová
Kyselina sírová (H2SO4) môže mať rôznu koncentráciu a čistotu. V bezvodom stave je bezfarebná olejovitá kvapalina, ktorá nemá zápach.
Teplota, pri ktorej sa látka nachádzataveniny, je 10 ° C. Teplota varu je 296 ° C. Rozpúšťa sa dobre vo vode. Pri rozpúšťaní kyseliny sírovej sa vytvárajú hydráty a uvoľňuje sa veľké množstvo tepla. Teplota varu všetkých vodných roztokov pri tlaku 760 mm Hg. Art. presahuje 100 ° С. Teplota varu sa zvyšuje so zvyšujúcou sa koncentráciou kyseliny.
Kyslé vlastnosti látky sa prejavujú pri interakcii s bázickými oxidmi a zásadami. H2SO4 dikyseliny, čím sa môžu tvoriť ako sulfáty (soli médiu) a hydrosulfáty (kyslá soľ), z ktorých väčšina sú rozpustné vo vode.
Najvýraznejšie vlastnosti kyseliny sírovej sa prejavujú v oxidačno-redukčných reakciách. Je to preto, že v zložení H2SO4 síra má vyšší oxidačný stav (+6). Ako príklad prejavu oxidačných vlastností kyseliny sírovej môžeme citovať reakciu s meďou:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Síra: užitočné vlastnosti
Síra je mikroelement nevyhnutnýživých organizmov. Je neoddeliteľnou súčasťou aminokyselín (metionín a cysteín), enzýmov a vitamínov. Tento prvok sa podieľa na tvorbe terciárnej štruktúry proteínu. Množstvo chemicky viazanej síry obsiahnutej v proteínoch je na hmotnostnom základe 0,8 až 2,4%. Obsah prvku v ľudskom tele je asi 2 gramy na 1 kg hmotnosti (tj asi 0,2% je síra).
Užitočné vlastnosti mikroelementov sú ťažképreceňovať. Pri ochrane protoplazmy krvi je síra aktívnym asistentom organizmu v boji proti škodlivým baktériám. Množstvo koagulácie závisí od jej množstva, to znamená, že prvok pomáha udržiavať jeho dostatočnú úroveň. Síra tiež zohráva dôležitú úlohu pri udržiavaní normálnych koncentrácií žlče produkovanej v tele.
Často sa nazýva "minerálom krásy", pretožeje jednoducho potrebné zachovať zdravie pokožky, nechtov a vlasov. Chere je neodmysliteľnou schopnosťou chrániť organizmus pred rôznymi druhmi negatívneho vplyvu prostredia. To pomáha spomaľovať proces starnutia. Síra čistí telo toxínov a chráni pred žiarením, čo je obzvlášť pravda, vzhľadom na súčasnú environmentálnu situáciu.
Nedostatočné množstvo stopových prvkov v tele môže viesť k slabému vylučovaniu trosiek, zníženej odolnosti a vitalite.
Síra je účastníkom bakteriálnej fotosyntézy. Je to zložka bakteriochlorofylu a sírovodík je zdrojom vodíka.
Síra: vlastnosti a aplikácie v priemysle
Najčastejšie sa používa síravýroba kyseliny sírovej. Tiež vlastnosti tejto látky umožňujú jej použitie na vulkanizáciu kaučuku, ako fungicíd v poľnohospodárstve a dokonca aj na liečivo (koloidná síra). Okrem toho sa síra používa na výrobu zápaliek a pyrotechnických zlúčenín, je súčasťou sírno-bitúmenových kompozícií na výrobu síranového asfaltu.
</ p>